1、前 言
钛及钛合金被广泛地应用为生物医用材料主要是由于其具有良好的生物相容性及耐腐蚀性能。钛及钛合金表面可自发形成氧化膜。该氧化膜一般为几个纳米 具有很高的稳定性。 使钛及钛合金在体外表现出很高的稳定性及耐腐蚀性,但有文献报道发现在体内钛及钛合金植入体周围的组织中有钛金属的沉积现象, 这主要是由于该植入体在体内行使功能时 其表面的氧化膜由于磨损或受到剪切力而遭到破坏,氧化膜破坏后 金属表面暴露,暴露的金属表面在体内一方面进一步再钝化形成新的氧化膜。另一方面由于电化学反应金属离子在体内溶解析出,再钝化形成的氧化膜的性质及金属离子溶解的速率与电化学反应的环境及金属材料的组成成分有关。
以往对钛合金的生物腐蚀行为的体外研究多采用 0.9% NaCl 及平衡盐溶液,与体内生物环境有很大差异,在体内的植入环境中,不但有无机盐溶液,还有各类蛋白质 酶及活性细胞 蛋白质对植入材料的生物腐蚀的影响已有很多研究,但体外模拟细胞环境对合金腐蚀影响的研究还很少, 本试验采用法国研制的生物反应器 Bioreactor 对几种钛合金进行生物腐蚀的电化学试验研究,该生物反应器具有如下特点:
1)可以控制温度在37℃±2℃;
2)可控制腐蚀环境pH值在7.40±0.02
3)通过注入氮气排除腐蚀环境中的氧
4)腐蚀容器可以消毒,使体外模拟材料在细胞培养液及活性细胞环境中的腐蚀情况成为可能。
Ti6Al4V 合金做为医用植入材料已被应用很多年,其在耐腐蚀性方面明显优于不锈钢及钴铬合金,但由于含有毒性元素钒使其在体内长期应用受到限制。由此一些新型的医用钛合金应运而生,以取代 Ti6Al4V 合金 Ti75, TiZr 合金不含毒性组元V,并以 Zr 做为主要合金元素,具有优良的生物相容性。 与 Ti6Al4V 合金相比,这两种合金虽在组成成分上具有较 Ti6Al4V 合金更优的生物相容性,但其生物腐蚀行为有待进一步研究。本实验采用 0.9% NaCl 溶液,细胞培养液及活性细胞等作为腐蚀液,在体外模拟生物体环境,对几种钛合金的生物腐蚀行为进行研究。
2、材料与方法
Ti6Al4V, Ti75, TiZr 合金均由西北有色金属研究院提供,将各种合金加工成直径12mm, 厚度1mm的圆片,表面用碳化硅砂纸磨光至1200号。试样表面用丙酮清洗,酒精超声清洗 10min 后,用去离子水清洗备用。
采用电解液为 0.9 % NaCl;细胞培养液 RPMI含 10 % 的小牛血清;细胞培养液 RPMI 含 10 %的小牛血清 加 10 000 个/ ml CEM 细胞。(人类起源的淋巴细胞系)
采用的电化学腐蚀仪 Bioreactor 由法国制造。参比电极为 Ag/AgCl 电极 辅助电极为 Pt 电极通过腐蚀仪外的热空气控制温度为 37.0 0.2,通过 0.01mol/L NaOH 或 CO 2 控制电解液的 pH值为 7.40 0.02,通过注入氮气排除电解液中的氧。
电化学测试方法参照标准 ISO/TC106/SC2/WG12NO8 进行,将清洗过的试样放入电极,工作电极调整电压强度使工作电极在-1 500mV/SCE, 维持15min,然后测量其自腐蚀电位 2 h,记录 2 h 的电压为该测量试样的自腐蚀电位 E r, 然后再调整电压强度使工作电极在-1 500mV/SCE, 维持 15 min 继续,进行极化曲线的测量,极化曲线测量采用的电压范围为-1 500 mV 至 4 000 mV 电压增长速度为 10mV/min,根据电压 电流密度绘制极化曲线,并求出腐蚀电位 E c 和维钝电流密度 I p 以上所有操作均在电脑控制下完成。
3、结果与讨论
3.1 腐蚀环境对钛合金自腐蚀电位 E r 的影响
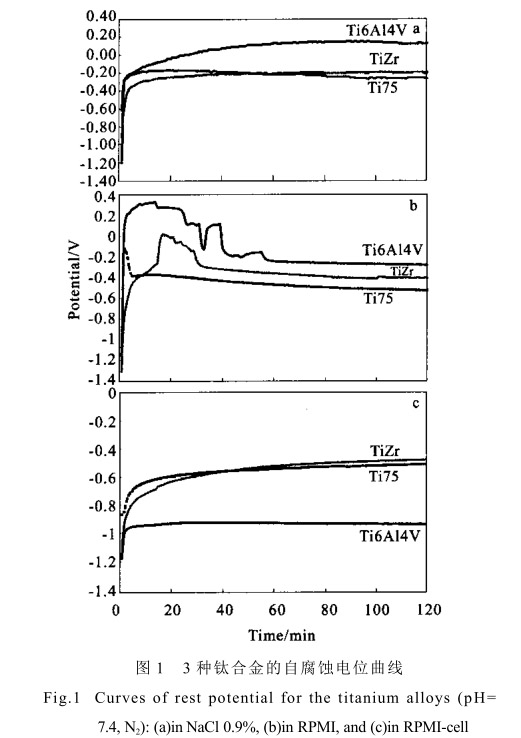
图 1 为 3 种钛合金在不同腐蚀液中的腐蚀电位-时间曲线。可以看出, 腐蚀电位经过初始迅速增加后在 20min 后趋于稳定,说明合金表面在腐蚀环境中形成表面膜 自腐蚀电位是腐蚀体系不受外加极化条件下的稳定电位,这一参数反映金属的热力学特性和金属电极的表面状态。在 0.9% NaCl 溶液中,Ti6Al4V 的腐蚀电位最高 +100mV Ti75 合金-250mV 与 TiZr -190mV 接近。当腐蚀溶液为含有 10 % 的小牛血清细胞培养液 RPMI 时,3 种合金的自腐蚀电位均明显降低 Ti6Al4V 的腐蚀电位降低了 360mV Ti75 合金与 TiZr 合金分别降低 270mV和210mV。当添加活性细胞后,Ti6Al4V的自腐蚀电位降低更加明显 -910mV 并低于 Ti75-500mV 与 TiZr -460mV 合金,而活细胞对Ti75 与 TiZr 合金的自腐蚀电位影响较小。说明生物环境对 Ti6Al4V 合金的表面氧化膜形成的影响较Ti75与 TiZr 合金大细胞培养液含有多种无机盐,氨基酸及维生素 与 0.9% NaCl 溶液相比更加接近人体的生理环境。钛合金在含有 10 % 的小牛血清细胞培养液RPMI 中 表面氧化膜的形成,受到其中带电荷的氨基酸及蛋白质分子的影响,使合金的热力学稳定性受到影响。当活性细胞添加后,活性细胞的代谢需要氧,因此在腐蚀溶液中与金属表面氧化膜形成过程中争夺氧,从而使 3 种钛合金的自腐蚀电位降低。说明 3 种合金在体外模拟生物体液中的自
腐蚀倾向明显高于单纯的 0.9% NaCl 溶液,且Ti6Al4V 合金较其它两种合金更明显。
3.2 腐蚀液对钛合金电化学行为影响
本实验中钛合金在外加极化条件下,电流密度为 0 时的电位为腐蚀电位,E c 当外加电压高于 E c后,钛金属电极处于活化状态。电流随着电压的增大而增加,随着金属表面钝化膜的形成 金属在腐蚀环境中转化为钝化状态,电流密度随电压的增加而保持不变。此时的电流密度为维钝电流密度 I p本研究中为了观察3 种钛合金在生物体液中的电化学行为,观察了电压在-1 500mV~1 200mV 间的电流密度变化。见图 2 。在人体环境中,人体电化学电位一般在 400mV~500mV 之间,因此观察 3 种合金在该期间的电化学行为就非常重要 与 0.9%NaCl 溶液中的腐蚀电位相比 3 种合金在含有 10 %的小牛血清细胞培养液中 E c 均降低,而且当活性细胞添加后 E c 进一步降低 影响 E c 的主要因素是腐蚀溶液的组成成分 及由此而产生的不同极化性。本实验结果说明含有 10 % 小牛血清细胞的培养液的极化性较 0.9% NaCl 溶液强 而且活性细胞的添加进一步增加其极化性。
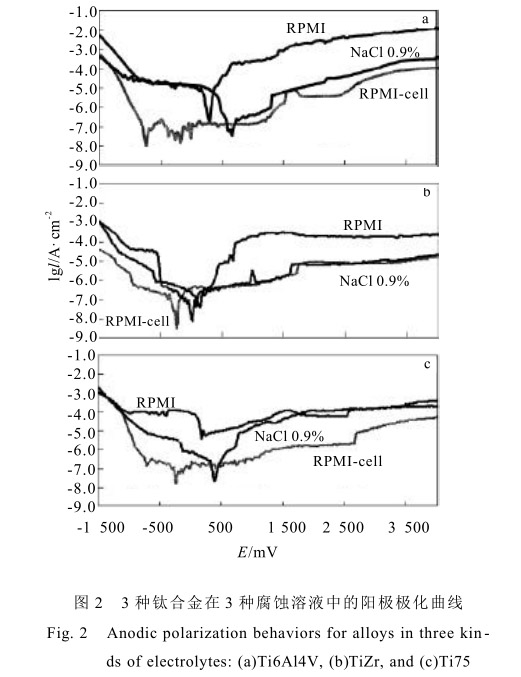
金属进入钝化态的稳定性与钝化电流密度 I P 相关 钝化态下的阳极电流密度实际上是钝化膜溶解速度的当量电流密度,钝化膜的溶解速度越小。钝化状态下的阳极电流密度就越小 金属在钝化态的腐蚀速度就越小 从本实验结果可以看出,在含有10 % 的小牛血清细胞培养液中 I P 均增加 这与金属由活化态进入钝化态的速度有关。金属在含有10 % 的小牛血清细胞培养液中钝化速度最慢,在金属表面就形成了大量的蛋白质,氨基酸的生物金属络合物,这些络合物的稳定性远远低于金属氧化物,使得金属在该腐蚀环境中形成的钝化膜的稳定性较低 维钝电流较高。但当添加活性细胞后 I P均降低,说明金属表面形成的钝化膜在添加活性细胞后稳定性增加,已有研究表明蛋白质影响金属的腐蚀行为,在含有蛋白质的细胞培养液中。金属的腐蚀受到很多因素的影响,如金属的表面化学成分,蛋白质的吸附,各种氨基酸与金属离子的反应,局部环境中阴极和阳级间电荷的转移等。在本实验中发现 3 种金属在含有蛋白质的细胞培养液中耐腐蚀性均降低M.A.Khan [9] 等认为蛋白质可以以多种方式参加腐蚀反应,蛋白质可以和金属离子联结,并将金属离子从金属表面移走。从而加速了金属离子的进一步溶解,蛋白质也可吸附在材料表面,从而阻止氧在金属表面的扩散,而影响金属钝化膜的形成。这两种反应都降低了金属的耐腐蚀性能。
当活性细胞加入后降低了细胞培养液中蛋白质成分对合金的腐蚀行为的影响。活性细胞在代谢过程中需要蛋白质及氨基酸等生物活性分子,同时分泌和产生各种酶类,这些反应干扰了蛋白质,氨基酸等生物活性分子与金属离子的反应。因此与其他两种腐蚀溶液相比3种合金的腐蚀电位最低,且表面很快钝化,使合金在该溶液中维钝电流密度较低。
3.3 关于合金组成成分对耐腐蚀性的影响
Ti6Al4V 合金为 á+â 相合金 Ti75 与 TiZr 合金均为近 á 合金 一般认为 â 相合金具有较高耐腐蚀性能,而 Ti75 与 TiZr 合金表现的较优良的耐腐蚀性,是由于合金化元素 Zr 的添加 Zr 元素的溶解性低于 Al 和 V 元素。而且其在钛表面形成的氧化膜为与钛结合紧密的金红石型结构,对底层的合金有很大的保护作用。由于 Ti75 合金中 Zr 含量较低 因此其耐腐蚀性能低于 TiZr 合金 对 Ti-13Nb-13Zr 合金的电化学研究实验发现 Nb, Zr 元素的添加使钛表面形成很强的保护性钝化膜,不宜于产生化学性破解 从而使钛合金表现出很低的溶解性 而且发现合金化元素形成的氧化物呈分离的束状镶嵌在钛表面的氧化基质当中。
4、结 论
1) 钛合金的生物腐蚀行为在接近人体生理环境的细胞培养液及活性细胞环境中,与在 0.9% NaCl溶液中有很大差异。因此单纯用 0.9% NaCl 溶液对合金的体外生物腐蚀行为进行评价是不科学的。
2) 3 种合金在 3 种腐蚀液中均具有较高的耐蚀性。Ti75 合金与 TiZr 合金在生物环境中比 Ti6Al4V合金具有更高的稳定性。
参考文献
[1] Fu Tao 付 涛 et al. Rare Metal Materials and Engineering(稀有金属材料与工程)[J], 2003, 32(2): 137
[2] Fu Tao 付 涛 et al. Rare Metal Materials and Engineering(稀有金属材料与工程)[J], 2000, 29(3): 168
[3] Jacobs J J, Skipor A K, Black J et al. Release and Excretion ofMetal in Patient Who Have a Total Hip-replacementComponent Made of Titanium-base Alloy[J]. J Bone Jt Surg,1991, 73A: 1 475
[4] Agins H J, Alcock N W, Bansal M et al. Metallic Wear inFailed Titanium-alloy Total Hip Replacement[J]. J Bone JtSurg, 1988, 70A: 347
[5] Jasty M. Clinical Reviews: Particulate Debris and Failure ofTotal Hip Replacements[J]. J Appl Biomater, 1993, 4: 273
[6] Walker P S, Gold B L. The Tribology (friction lubrication andwear) of All-metal Artificial Hip Joints[J]. Wear, 1971, 17: 285
[7] Velten D, Biehl V, Aubertin F, Valeske B, Possart W, Bre-me J. Preparation of TiO 2 Layers on cp-Ti and Ti6Al4V byThermal and Anodic Oxidation and by Sol-gel CoatingTechniques and Their Characterization[J]. J Biomed MaterRes, 2002, 59: 18~28
[8] Chern Lin J H, Lo S J, JU C P. Biocorrosion Study ofTitanium-cobalt Alloys[J]. Journal of Oral Rehabilitation,1995, 22: 331~335
[9] Sousa S R, Barbosa M A. Corrosion Resistance of Titani-um cp in Salin Physiological Solutions with CalciumPhosphate and Protein[J]. Clin Mater, 1993, 12: 1~4
[10] Khan M A, Williams R L, Williams D F. ConjointCorrosion and Wear in Titanium Alloys[J]. Biomaterials,1999, 20: 765~772
[11] Zhang Yumei (张玉梅), Guo Tianwen (郭天文), Li Zuochen(李佐臣) et al. Rare Metal Materials and Engineering (稀有金属材料与工程)[J], 1999, 28(2): 125
[12] Khan M A, Williams R L, Williams D F. The CorrosionBehavior of Ti6Al4V, Ti6Al7Nb and Ti13Nb13Zr inProtein Solutions[J]. Biomaterials, 1999, 21: 631~637
[13] Davidson J A, Mishra A K, Kovacs P, Poggie R A. NewSurface-hardened, Low Modulus, Corrosion ResistantTi13Nb13Zr Alloy for Total Hip Arthroplasty[J]. BiomedMater Eng, 1994, 4: 321~243
相关链接
- 2021-09-27 Ti31Ti80Ti75钛锻件钛合金棒在海洋工程装备中的应用实例
- 2021-08-29 我国舰船用钛及钛合金体系、性能、应用
- 2021-08-13 Ti75钛合金锻件热处理工艺对组织和性能的影响
- 2021-06-30 钛合金材料在舰艇中的应用及需求分析
- 2021-06-21 宝鸡TC4/Ti75钛合金厂家谈海洋金属的特性与主要应用
- 2021-05-25 TI80/Ti75/Ti31钛棒钛锻件耐压壳体在船舶建造中的应用
- 2021-01-29 海洋工程用Ti31/Ti75/Ti80/TC4钛合金的特性与应用
- 2020-07-29 热加工工艺对Ti75合金管坯组织及性能的影响
- 2020-03-23 海洋工程用Ti75钛合金棒材的切削加工特点和减少刀具磨损的方法
- 2019-11-17 船用Ti75钛棒钛锻件等合金表面微弧氧化研究

